מושתלים
מנהלי קהילה



מובילי קהילה


הפיתוחים בתחום ההשתלות שיאפשרו לצאת לחירות
לא פחות ממדהים: לקראת הפסח ריכזנו את החידושים בתחום השתלות האיברים - מאיברים מחזירים, דרך רחפנים לשינוע איברים ועד הדפסת איברים במדפסת תלת ממד

בשנים האחרונות מחמיר המחסור העולמי באיברים להשתלות, ותורי ההמתנה להשתלות מתארכים. משנת 2020, בעקבות התפרצות מגפת הקורונה בעולם, תמונת המצב אף החריפה, כשמדינות רבות דיווחו על ירידה בתרומות איברים והתארכות רשימות ההמתנה.
בישראל, דו"ח של המרכז הלאומי להשתלות שפורסם בינואר 2022 בכתב העת Israel Journal of Health Policy Research, מתעד בשנת 2020 שבה פרצה המגפה ירידה של 24.2% במספר השתלות האיברים במדינה, מ-306 השתלות בשנת 2019 ל-232 בלבד בשנת 2020, לצד עלייה של 10% ברשימת הממתינים להשתלות, מ-1,153 בשנת 2019 ל-1266 בשנת 2020. ככלל, בעשור האחרון גדל ב-16% מספר הממתינים להשתלות בישראל. בשנת 2021 הצטרפו לרשימת ההמתנה 746 חולים, ומתו 68 חולים.
על רקע המצב המדאיג, רבים תולים תקוות בפיתוחים חדשים המבוססים על טכנולוגיות מתקדמות אשר מבקשים לפתור את מצוקת האיברים להשתלות ולהציל חיים. לקראת חג הפסח בו אנו חוגגים את צאתו של עם ישראל מעבדות לחירות, "כמוני" מציג פריצות דרך בתחום ההשתלות שמבקשות לקדם אותנו לימים טובים יותר ולפתור את המשבר העולמי בתחום.
איברים מחזירים מהונדסים גנטית
(צילום: shutterstock)
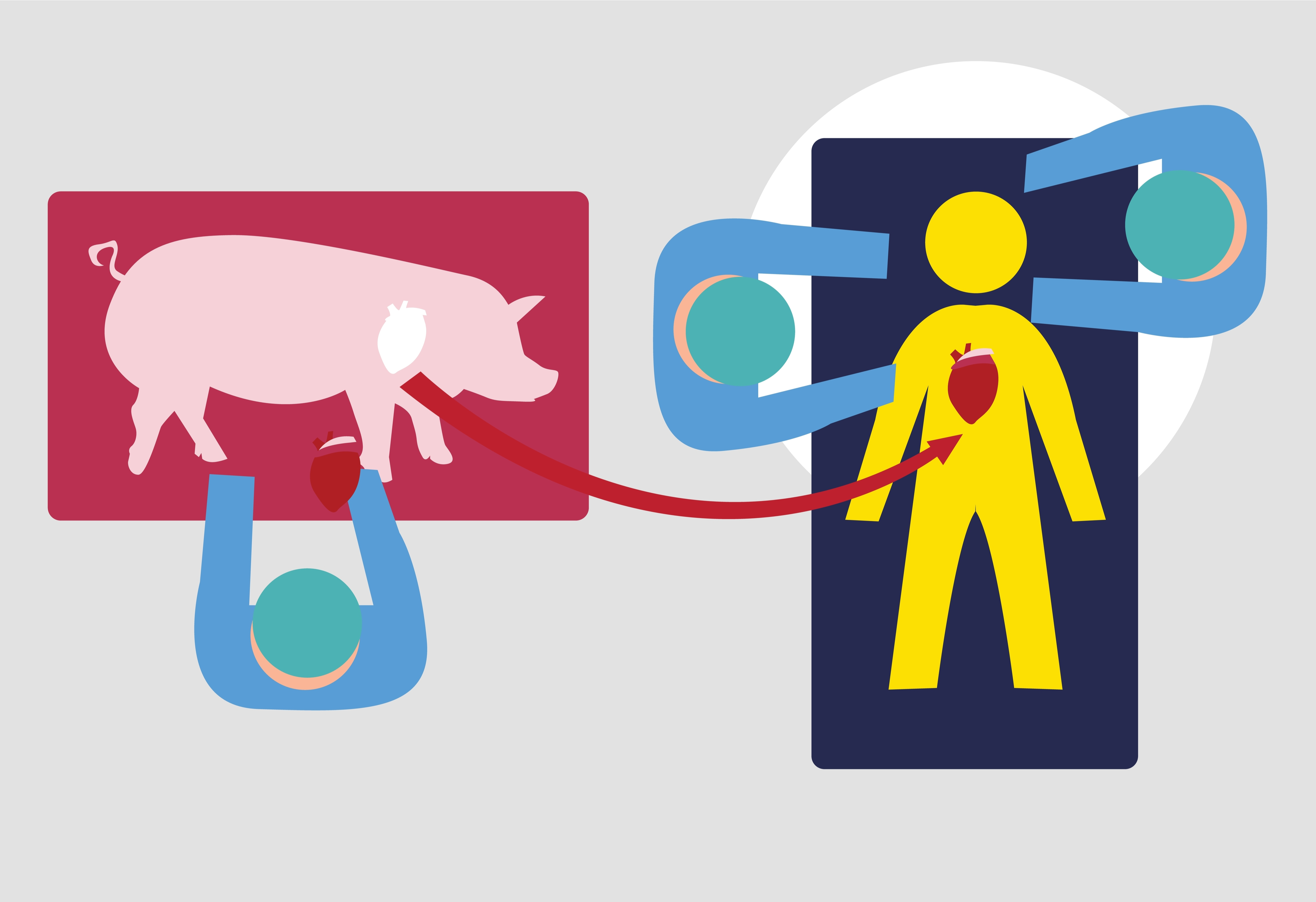
פריצת הדרך המרכזית של השנה האחרונה בתחום ההשתלות מגיעה מארה"ב, וקשורה בהשתלת איברים שמקורם בחזירים מהונדסים. חוקרים רבים עמלו שנים ארוכות לבחון את האפשרות להשתיל בבני אדם איברים שמקורם בחיות – תחום המכונה ברפואה Xenotransplsantation (ובעברית: "השתלה שלא מבן מינו"), אולם רוב המחקרים בעבר כשלו והובילו להתפתחות תגובות חמורות עד כדי קטלניות של דחיית השתל מצד הגוף האנושי. המהפך הדרמטי הגיע לאחר שחוקרים הצליחו לגדל חזירים מהונדסים, שעברו שינויים גנטיים הגורמים לכך שאיבריהם לא יידחו על ידי בני אדם.
ציון דרך נרשם עוד בשנת 2012 עם פיתוח טכנולוגית הקריספר ובשמה המלא 'Crispr-Cas 9', טכנולוגיה שאף זיכתה את ממציאותיה מארה"ב וגרמניה בפרס נובל בכימיה לשנת 2020. הטכנולוגיה מאפשרת לבצע "עריכה" של גנים באמצעים פשוטים ונגישים יחסית באמצעות מעין "מספריים מולקולריות" שביכולתן לערוך כמעט כל רצף בדי.אנ.איי של התאים. באמצעות שיטה זו ניתן להוציא תכונות מסוימות מהמטען הגנטי בתאי החיות המהונדסות, לרבות תכונות שמובילות לכך שאיבריהן יידחו כשיושתלו בבני אדם. לאחר ניסויים בחיות, השנה צעד התחום כברת דרך, כשדווח לראשונה על השתלות מוצלחות של איברים אלה.
באוקטובר 2021 דיווחו רופאים אמריקאים מהמרכז הרפואי NYU Langone המסונף לאוניברסיטת ניו יורק (NYU) לראשונה על כליה שנלקחה מחזיר שעבר הנדוס גנטי והחלה לפעול באופן תקין דקות לאחר שחוברה למטופלת שמתה מוות מוחי. בדצמבר 2021 דיווחו הרופאים על השתלה שנייה מוצלחת של כליית חזיר מהונדס גנטית באדם שמת מוות מוחי.
בינואר 2022 הוכה העולם בתדהמה כשרופאים מהמרכז הרפואי באוניברסיטת מרילנד דיווחו לראשונה על השתלה מוצלחת של לב חזיר מהונדס גנטית בחולה עם אי ספיקת לב סופנית שהיה נתון בסכנת מוות אם לא יעבור השתלת לב מיידית. במקרה זה בוצעו בחזיר המהונדס עשר התאמות גנטיות, כאשר ארבעה גנים נוטרלו לחלוטין, לרבות גן אחד שמקודד למולקולה הגורמת לתגובה אגרסיבית של דחיית שתל בבני אדם, וגן נוסף נוטרל במטרה למנוע מלב החזיר להמשיך ולגדול לאחר ההשתלה בגוף החולה. בנוסף, למטען הגנטי (הגנום) של החזיר המהונדס הוחדרו גנים אנושיים במטרה להפוך את איבריו לידידותיים יותר עבור המערכת החיסונית האנושית לאחר ההשתלה.
עם זאת, חרף תקוות רבות שנתלו בהליך, המושתל – דיוויד בנט בן ה-57 מת כעבור חודשיים מההשתלה. לפי דיווחים בארה"ב, נסיבות מותו עדיין נבדקות ולא ניתן עדיין לקבוע בוודאות האם נגרם כתוצאה מדחייה של לב החזיר או מסיבה אחרת. בהודעה לעיתונות הבהירו רופאיו כי "לאחר הניתוח, הלב המושתל עבד באופן מצוין למספר שבועות ללא כל סימן לדחייה. המטופל יכול היה לבלות זמן עם משפחתו ולהשתתף בטיפולי פיזיותרפיה כדי להתחזק. הוא צפה ב'סופרבול' עם המטפל שלו, ודיבר הרבה על כך שרצה להגיע הביתה לכלב שלו לאקי".
הרופאים הוסיפו כי החולה תרם רבות למדע בכך שהדגים כי לב מחזיר מהונדס "יכול לתפקוד היטב בגוף האדם כשהמערכת החיסונית מדוכאת באופן מבוקר. אנו נותרים אופטימיים ומתכננים להמשיך בכיוון זה במחקרים קליניים עתידיים".
לדברי פרופ' מרדכי קרמר, מנהל המערך למחלות ריאה והשתלות ריאה בבית החולים בילינסון מקבוצת הכללית וממנהלי קהילת מושתלים ב״כמוני״, "השתלת איברי חיות מהונדסות היא אחד הכיוונים העתידיים המבטיחים בתחום ההשתלות".
ביוני 2021 דיווחו חוקרים ישראלים מבית חולים בילינסון בכתב העת Scientific Reports על פיתוח נוסף שנחקר לאחרונה בחיות: השתלות איברים היברידיים: איברים שמקורם בבעלי חיים אשר מצופים באמצעות תהליכי הנדסה גנטית בכלי דם שהורכבו מתאי שליה אנושית, וזאת במטרה לסייע לקליטתם המוצלחת בגוף החולה.
מזל"טים / רחפנים לשינוע איברים

(צילום: shutterstock)
המחסור באיברים להשתלות הוביל עם השנים לפיתוח שיטות מקוריות לשינוע מהיר של איברים לחולים קשים – גם באמצעות רחפנים או מזל"טים (מטוסים זעירים ללא טייס).
באפריל 2019 דיווחו רופאים מאוניברסיטת מרילנד על השתלה ראשונה בעולם של איבר שהועבר באמצעות מזל"ט - כליה שהושתלה במטופלת בת 44. הכליה הוטסה כשהיא מצויה בתוך כלי אטום עם חומר שימור לאורך העיר בולטימור בארה״ב - וגמעה 4.2 קילומטרים במשך 10 דקות, בדרך שאורכת בנסיעה ברכב חירום זמן כפול: כ-20 דקות.
דיווחים דומים התקבלו מאז ממדינות נוספות בארה"ב. בספטמבר 2020 דווח במדינת נבדה על העברת כליות וקרניות באמצעות רחפנים, ובמאי 2021 דווח במדינת מינסוטה על העברת לבלב באמצעות רחפן. באוקטובר 2021 דווח בקנדה על רחפן שהעביר שתי אונות ריאה להשתלה.
זילוח להארכת משך הזמן שהאיבר נשמר מחוץ לגוף
בשנים האחרונות פותחו שיטות מתקדמות נוספות לאפשר שינוע איברים מאזורים מרוחקים, שמטרתן לשפר את שרידות האיבר מחוץ לגוף לאורך זמן כדי להצליח להעבירו בחלון זמנים ארוך יותר מהוצאת האיבר מהתורם המת ועד להשתלה – אחת השיטות האלו היא באמצעות מכשיר שמבצע "זילוח" (פרפוזיה – הזרמת נוזל ברקמה).
בארה"ב דווח ביולי 2020 על שימוש במערכת המבצעת זילוח, שאפשרה את הכפלת משך השהות של אונת ריאה המיועדת להשתלה מחוץ לגוף, מ-6 שעות ל-12 שעות ואולי אף מעבר לכך.
המערכת המכונה בקיצור EVLP (קיצור של Ex Vivo Lung Perfusion) נכנסה לשימוש בשנה האחרונה גם בישראל. "מדובר בשיטה באמצעותה הריאה מוצאת מגוף התורם עם הלב ומחוברת למכשיר שמזרים את הדם דרך האיבר, באופן שמאפשר לשמר את האיבר זמן רב יותר מחוץ לגוף״ מסביר פרופ׳ קרמר. ״השיטה תורמת לא רק להארכת הזמן להעברת איברים ממקומות מרוחקים, אלא גם מאפשרת הערכה טובה יותר לריאה לפני ההשתלה, תוך בדיקת גמישות הריאה בעודה מחוץ לגוף. במערכת החדשה הריאה יכולה לעבור ניקוי וברונכוסקופיה ולשפר את איכותה לקראת ההשתלה".
הדפסת איברים

(צילום: shutterstock)
כיוון טכנולוגי חדשני נוסף שמעורר תקוות לפתרון המחסור העולמי באיברים הוא בהדפסה תלת ממדית של איברים להשתלות. למרות שטכנולוגיה שכזו עוד נשמעת כמו מדע בדיוני, חוקרים רשמו בשנים האחרונות כמה פריצות דרך בתחום.
עוד באפריל 2006, דווח בכתב העת Lancet כי מדענים הצליחו לפתח רקמות של שלפוחית השתן במדפסת תלת מימד – רקמות שהושתלו בהצלחה בגופם של חולים עם מחלות מתקדמות בשלפוחית. בשנת 2011 הודגם על ידי אותו צוות ניסוי ראשוני בהדפסה של כליה אנושית.
בשנת 2010 הכריזה חברתOrganovo מארה"ב כי הצליחה לפתח מדפסת תלת ממד שמאפשרת להדפיס איברים להשתלה. המדפסת הביולוגית הדגימה הצלחה בהדפסת עורקים, והמומחים חזו כי בהמשך תוכל להדפיס כלי דם לניתוחי מעקפים וכן להדפיס רקמות ואיברים מורכבים יותר, לרבות לב אנושי.
בשנים האחרונות כבר נכנסו לשימוש בבני אדם הדפסות תלת ממד של רקמות עצם במדפסות תלת ממד. באפריל 2021 דיווחו חוקרים מאוסטרליה על פיתוח מדפסת תלת ממד שמסוגלת להדפיס עצמות הכוללות תאים חיים – ישירות לתוך גופם של מטופלים. כמו כן, במאי 2018 דיווחו חוקרים בריטים מאוניברסיטת ניוקאסל על קרנית מלאכותית ראשונה בעולם שהופקה בעזרת מדפסות תלת ממד. בחודש שעבר (מארס 2022) דיווחו חוקרים ישראלים משערי צדק כי הצליחו להשתיל בהצלחה את הקרנית המלאכותית הדקה בעולם, רק 50 מיקרון עובייה, אשר יוצרה במדפסת תלת ממד על ידי חברת הסטארטאפ הישראלית EYEYON.
מומחים העוסקים בפיתוח מדפסות ביולוגיות טוענים כי רקמות ביולוגיות שנחשבות "קלות יותר להדפסה" כוללות רקמות עור וכלי דם, ובהמשך איברים פנימיים כמו שלפוחית השתן והקיבה, בעוד שכליות, כבד, לב וריאות נחשבים עדיין לאיברים מורכבים במיוחד להדפסה.
בשנת 2017 דיווחה החברה בכתב העת Lab Animal כי הצליחה להדפיס רקמת כבד תלת ממדית ולהדגים כיצד לאחר שהושתלה בעכברים, הרקמה נקלטה בהצלחה ובאופן שהוביל ליצירת חלבונים שנוצרים במקור בכבד.
במדפסות תלת ממד שמפותחות למטרת הדפסת איברים נעשה שימוש ב"דיו ביולוגי" (bioink), שמורכב מתאים אנושיים במקום מחומר כמו פלסטיק או מתכת. החוקרים מקווים כי שימוש בתאים אנושיים להדפסת האיברים החדשים, אם יוכח כבטוח ויעיל, עשוי לחסוך בעתיד את הצורך להשתמש בתרופות נוגדות דחיית שתל.
יש לציין כי טכנולוגיה זו מעבר למורכבותה גם יקרה מאוד. לפי הערכות, תאי לב לשימוש במדפסת תלת ממד מתומחרים כיום בשווי של 100,000 דולר. לפי תחזיות, ניסויים ראשונים בשיטה החדשה יחלו בעשור הקרוב, ואילו הדפסה תלת ממדית של איברים להשתלה תתאפשר תוך שלושה עשורים.
לדברי פרופ' קרמר, "כיום כבר ניתן להדפיס את מבנה האיברים במדפסת תלת ממד, אך עדיין לא הגיעו לשלב של הדפסת רקמה שתאפשר את אותה הפונקציה של איבר אנושי. הדפסות תלת ממד של עצמות, למשל עצם לסת או חוליית עצם, פשוטות יותר, כי ברקמה אין פונקציה ביוכימית מורכבת. האתגר לפתח בשיטה זו רקמות מורכבות, למשל כאלו שצריכות לקבל ולהוציא דם".
השתלות לחולי סרטן
אחד התחומים החדשים שהחל לצבור תאוצה בשנה החולפת הוא בקידום השתלות איברים לטיפול בגידולים סרטניים. אמנם בעבר חולי סרטן שעברו השתלות איברים לרוב חוו חזרה של הגידול הסרטני, אולם טכנולוגיות דימות חדשות לחולי סרטן מאפשרות כיום להעריך טוב יותר את מידת התפשטות הסרטן בגוף, ובמצבים בהם הגידול הסרטני מוגבל לאיבר החולה, לכאורה ניתן לבצע השתלה של אותו האיבר לאחר ניתוח שבו מנוקה הגידול הסרטני במלואו – מה שעשוי לקדם ריפוי מוצלח מהסרטן.
בעקבות תפיסה זו קידמו בשנה האחרונה צוותים רפואיים אמריקאים מהמרכז הרפואי נורת'ווסטרן בשיקגו השתלה כפולה מוצלחת של שתי אונות ריאה לחולה סרטן ריאות בן 54, אשר הגידול הסרטני בגופו אמנם היה גרורתי אך מוגבל לאזור בית החזה בלבד.
בניתוח ההשתלה הדרמטי שבוצע בספטמבר 2021 וארך כשבע שעות, נדרשו הצוותים לנקות מיליארדי תאים ממאירים מאזור הריאות במהירות ואף בזהירות רבה, וכיום - יותר מחצי שנה לאחר ההשתלה - אין כל סימן לסרטן בגופו.
לדברי פרופ' קרמר, מדובר בכיוון מעודד ביותר, גם על פי נתוני השתלות ריאה שבוצעו בישראל. "לאורך השנים היו לנו 15 חולים שעברו השתלת ריאות, ורק בהמשך כשהוצאנו את הריאות והעברנו אותן לבדיקות פתולוגיות, זוהו בהן בדיעבד תאים ממאירים, והתברר שהיה מדובר בחולי סרטן ריאות", מספר פרופ' קרמר, "כמובן שבמצב הזה לא היינו יכולים לעצור את ההשתלות באמצע, והן הושלמו, ובהמשך התברר כי לחולים אלה היו תוצאות טובות ביותר וללא חזרה של הגידול הסרטני. הנושא עוד דורש העמקה, אך בינתיים התוצאות מבטיחות".
גידול תאים במעבדה

(צילום: shutterstock)
מעבר להדפסת איברים במדפסות ביולוגיות, בשנים האחרונות מדווח על פריצות דרך מחקריות שעושות שימוש בשיטות נוספות בניסיון לייצר איברים במעבדה. תחום זה מתפתח תחת הענף המחקרי של 'רפואה רגנרטיבית' השואף לטפל במומים בגוף האדם באמצעות תרפיה תאית ויצירת איברים ורקמות דרך הנדסת רקמות, שמפותחות ומגודלות בתנאי מעבדה.
באופן זה, חוקרים בריטיים מאוניברסיטת קיימברידג' דיווחו בפברואר 2021 בכתב העת Science כי הצליחו לגדל בתנאי מעבדה צינורות מרה, שעשויים בעתיד לשמש במצבים מסוימים כתחליף להשתלות כבד. למרות שהכבד האנושי הוא בעל יכולת התחדשות טבעית, פגיעה בצינורות המרה עלולה להתפתח במקרים מסוימים לכדי אי ספיקת כבד סופנית שמחייבת השתלת כבד. לפי הערכות, כשל בצינורות המרה מהווה אינדיקציה ל-30% מהשתלות הכבד בבוגרים ועד 70% מהשתלות הכבד של ילדים. החוקרים הבריטיים הדגימו כיצד גידלו בתנאי מעבדה תאים של צינורות מרה המכונים בעגה הרפואית 'תאים כולנגיוציטים', וכשתאים אלה הושתלו בעכברים עם פגיעות כבדיות, הם עוררו צמיחה טבעית של תאי כבד תקינים.
שיטות מסוג זה עשויות לאפשר בעתיד שימוש ברקמות שגודלו בתנאי המעבדה כתחליף להשתלות איברים נוספים.
תאי גזע לשיבוט איברים
אחד הכיוונים ברפואה הרגנרטיבית, שחוקרים רבים עמלים על פיתוחו, מתמקד בתאי גזע – תאים שלא עברו תהליך התמיינות סופי, ועל כן יש באפשרותם למעשה להתפתח לתאים פעילים מסוגים שונים. המאמץ מתמקד בשיטות שיאפשרו לפתח באמצעות תאי גזע רקמות אנושיות שיוכלו להחליף בעתיד איברים חיים.
בשנים האחרונות התפתח כיוון המחקר באופן משמעותי לאחר שהוכחה היכולת להפיק תאי גזע לא רק בשלב העוברי, אלא גם אצל אנשים בוגרים – ואפילו מרקמות שומן שנשאב מהבטן.
בבעלי חיים כבר הצליחו חוקרים להדגים את האפשרות לפתח רקמת איבר שלם מתא גזע בודד. כך, למשל, בדצמבר 2008 דיווחו חוקרים אמריקאים בכתב העת Nature כי הצליחו לבודד תא גזע בודד מרקמת אפיתליום של הערמונית של עכבר בוגר, ולהפיק באמצעותה ערמונית מתפקדת.
במחקר פורץ דרך להוכחת ההיתכנות, שפורסם על ידי חוקרים אמריקאים מאוניברסיטת מרילנד בדצמבר 2020 בכתב העת Stem Cell Reports, התברר כי תאי גזע שהופקו מרקמות חזירים יכולים לשמש לשיבוט איברים שניתן יהיה להשתיל בגופם של בני אדם. החוקרים הדגימו כיצד כשתאי הגזע הוזרקו לעוברי חיות, הם הובילו להתפתחות רק של איבר המטרה שתוכנתו מראש ליצור, למשל כבד או קיבה, וזאת באופן שמבסס את האפשרות לטפל בתאי גזע בעתיד כתחליף להשתלות איברים.
לדברי פרופ' קרמר, "תיאורטית מדובר בתחום מבטיח, אם כי יש גם דיווחים מפוקפקים ממספר מדינות בעולם. עד כה לא הצליחו להדגים כיצד תא גזע עשוי להתפתח לרקמת ריאה נורמלית, אם כי רבים תולים תקוות בכיוון שכזה".
איברים מלאכותיים
מעבר לשימוש בחומרים ביולוגיים ליצור תחליפים לאיברים להשתלות, נרשמת בשנים האחרונות גם התקדמות בפיתוח טכנולוגיות שיוכלו לשמש כאיברים מלאכותיים.
בשנים האחרונות הוטמעה באופן זה טכנולוגית הלב המלאכותי: מעל לחמישים שנים כבר חלפו מאז ההשתלה הראשונה של לב מלאכותי בארה"ב באפריל 1969, ולמרות שהמושתל מת כעבור 64 שעות, בשעות הראשונות לאחר ההשתלה דווח כי הלב המלאכותי שאליו חובר הצליח להוביל דם לכליות ולמוח. הלבבות המלאכותיים מורכבים ממתכות שונות ומאפשרים הזרמה של דם מחומצן לעורקים ולרקמות גוף והזרמת דם עשיר בפחמן דו חמצני לריאות. בשנים הראשונות הלב המלאכותי היה למעשה מכונה חיצונית ענקית שאליה מתחבר החולה, אך עם הזמן גודל הלבבות המלאכותיים הלך והצטמצם – ללב מלאכותי בגודל של מזוודת טרולי שנישאת לצד המטופל, ובשנים האחרונות ללבבות מלאכותיים קטנים במיוחד, שניתנים להשתלה בגופם של חולים עם אי ספיקת לב קשה ועשויים לשמש כפתרון זמני עד להשתלת לב, שעשוי אף להחזיק מעמד לשנים ארוכות. בספטמבר 2019 דווח על הודי בן 63 תושב כלכותה, שחי עם לב מלאכותי כבר במשך עשר שנים.
חוקרים רבים עמלים על פתרונות של לב מלאכותי שיוכל לשמש תחליף קבוע להשתלת לב ופתרון טיפולי למחלות לב, שהן מהמחלות הנפוצות באוכלוסייה.
לצד ההתפתחות בתחום הלבבות המלאכותיים, מדענים עמלים גם על פיתוח איברים מלאכותיים נוספים, אם כי טכנולוגיות אלה מתקדמות באיטיות לאור מורכבותם של איברי גוף האדם אשר מקשים על תהליך הפיתוח.
לאחרונה, באוקטובר 2021, דווח על פריצת דרך של חוקרים אמריקאים מאוניברסיטת קליפורניה בסן פרנסיסקו ואוניברסיטת ונדרבליט, שהצליחו לפתח דגם ראשון של כליה מלאכותית המיוצרת מחומרים סינטטיים, שעשויה בעתיד לשמש כתחליף להשתלות כליה ללא הצורך בטיפולי דיאליזה. הכליה המלאכותית שפותחה, שממדיה הקטנים כגודלו של טלפון חכם, מאפשרת תיאורטית את השתלתה בגוף האדם, ומורכבת משני חלקים חיוניים שהדגימו הצלחה במחקרים שפורסמו בספרות הרפואית: פילטר להוצאת נוזלים ורעלים מהגוף בתהליך הקרוי 'המופילטרציה' ומכשיר ביוראקטור המורכב בצורת צינוריות אשר מווסתות את נפח המים ומייצרות איזון של חומרים ואלקטרוליטים בדם, כפי שמתבצע בכליות אנושיות.
בגרמניה מדווח בשנים האחרונות צוות חוקרים מהמרכז הרפואי בהאנובר, על מאמצים לפיתוח של ריאה מלאכותית שעשויה לסייע לאנשים עם אי ספיקת ריאות סופנית שנזקקים להשתלת ריאה דחופה להצלת חייהם. מכשיר ה'אקמו' שמחליף את הפעילות הריאתית, מספק כיום תמיכה זמנית במקרה של הפסקה בתפקוד הריאות לרוב למספר ימים עד שבועות בלבד, וזאת מאחר שדם שמוזרם בצינורות המכשיר נוטה עם הזמן לפתח קרישי דם שעלולים להיות מסוכנים. כדי להתגבר על בעיה זו, בריאה המלאכותית שמפותחת, ציפוי הצינורות מתבצע על ידי תאי אנדותל מהונדסים במטרה למנוע היווצרות קרישי דם.
ואילו פיתוחו של כבד מלאכותי מקודם אף הוא באחרונה על ידי צוות חוקרים במרכז הרפואי האמריקאי מאיו קליניק במינסוטה – כתחליף עתידי להשתלת כבד. המכשיר שמכונה SRBAL הדגים עד כה בחזירים שיפור במצב של אי ספיקת כבד ובהישרדות הכוללת במסגרת מחקר שפורסם בינואר 2019 בכתב העת Hepatology. המכשיר דומה למכשירי דיאליזה המשמשים לטיפול באי ספיקת כליות, ומתוכנן לאפשר חיבור של מטופלים למשך מספר שעות ביום לביצוע פעולות כבד חיוניות במצבים של אי ספיקת כבד. מאחר ופעילות הכבד מורכבת יותר מזו של הכליות, וכוללת בין השאר פעילות מטבולית ייחודית, הפרשת רעלים וייצור חלבונים שונים, הכבד המלאכותי מכיל גם תאים חיים שמופקים מרקמות כבד של חזירים, בשאיפה לאפשר את ביצוען של פעולות ייחודיות אלו.
איברים עם סוג דם אוניברסלי

(צילום: shutterstock)
אחת המגבלות שמשפיעה על מצוקת האיברים העולמית קשורה בצורך בהתאמה בין התורמים למושתלים מבחינת סוג הדם וסיווג הרקמות. סמני סוג הדם הינם למעשה נוגדנים (אנטיגנים) שמצויים על מעטפת כדוריות הדם האדומות, כאשר לבעלי סוג דם A ישנו נוגדן מסוג 'אנטיגן A'; לבעלי סוג דם B נוגדן מסוג 'אנטיגן B'; לבעלי סוג דם AB יש את שני הנוגדנים; ולבעלי סוג דם O אין כלל נוגדנים מסוגים אלה. הנוגדנים הללו מצויים גם בציפוי של כלי דם ואיברים בגוף האדם, ונוטים לתקוף דם מסוג זר שחודר לגוף.
אדם עם סוג דם O נחשב ל"תורם אוניברסלי" שיכול לתרום איברים לחולה עם כל סוג דם. אדם עם סוג דם A יוכל לתרום רק לחולים עם סוג דם A או AB; אדם עם סוג דם B יוכל לתרום רק לחולים עם סוג דם B או AB; ואדם עם סוג דם AB יוכל לתרום רק לחולה עם סוג דם AB. כך חולים עם סוג דם O למעשה יוכלו לקבל תרומת איברים רק מאדם עם אותו סוג דם. אם לחולה יושתל איבר מתורם עם סוג דם שאינו מתאים לו, הדבר עשוי לגרות את המערכת החיסונית לפעולה שתוביל לדחייה מיידית של האיבר המושתל.
מגבלת סוג הדם מתבטאת בהתארכות תורי ההמתנה לחולים עם סוג דם O. כך, למשל, בקנדה הדגים מחקר שפורסם ביוני 2008 בכתב העת Health Care Management Science כי זמן ההמתנה להשתלת כבד אורך כשלושה חודשים לבעלי סוג דם AB, שישה חודשים לבעלי סוג דם A, 7 חודשים לבעלי סוג דם B ו-10 חודשים לבעלי סוג דם O.
בשנים האחרונות עמלים צוותי חוקרים שונים כדי לנסות ולהתגבר על מגבלת סוג הדם, ולבצע הליך כלשהו באיברים שמיועדים להשתלה במטרה לנטרל את הנוגדנים שבכדוריות הדם האדומות, וזאת באופן שיאפשר להפוך כל איבר שמועבר לתרומה לאוניברסלי – כזה שניתן יהיה להשתיל בכל חולה ללא מגבלות לפי סוג הדם.
באחת השיטות, שמאפשרת כיום במצבים מסוימים לבצע השתלות איברים מתורמים למושתלים ללא התאמה בסוג הדם, דם של החולה הממתין להשתלה עובר הפרדה בתהליך רפואי הקרוי 'פלסמה פרזיס' – הכדוריות האדומות מוחזרות לגופו ואילו נוזל נסיוב הדם שמכיל את נוגדני סוג הדם מוחלף בנוזל חלבוני. בהמשך מוזרק לגוף החומר 'גמאגלובולין' שמונע מהנוגדנים שנותרו בו לפעול, ולבסוף מוזרק התכשיר 'ריטוקסימאב' שמנטרל תאי דם לבנים מסוג B אשר תפקידם לייצר נוגדנים חדשים. לאחר חזרה על הפעולה כשלוש-ארבע פעמים במשך כשבועיים, כשכמות הנוגדנים שנותרו בדם נותרת מזערית עד אפסית – ניתן לבצע את השתלת איבר ללא התאמה של סוג הדם. עם זאת, הפעולה אינה מתאימה להשתלות איברים מהמת שדורשות איתור מידי של חולה להשתלה, ומתאפשרת רק בהשתלות מתורמי איברים חיים. שיטה זו אף יושמה במרכזים רפואיים בישראל החל משנת 2010.
בפברואר 2022 דיווחו חוקרים מקנדה על פריצת דרך נוספת בדרך לאפשר השתלות איברים מהמת ללא צורך בהתאמת סוג הדם: החוקרים מצאו שיטה להפוך את סוג הדם באיבר המיועד להשתלה ל'סוג דם אוניברסלי' – כלומר לסוג דם O שמאפשר את השתלת האיבר לכל חולה ללא צורך בהתאמת סוג הדם.
החוקרים השתמשו במערכת טכנולוגית המבצעת "זילוח" (פרפוזיה – הזרמת נוזל ברקמה) של הריאות מחוץ לגוף (מערכת EVLP שמשמשת גם לשיפור היכולת לשימור איברים זמן רב יותר מחוץ לגוף), והזרימו דרכה נוזלים לאונת ריאה שמיועדת להשתלה מתורם איברים שנפטר ממוות מוחי בעל סוג דם A. הנוזלים הכילו הרכב ייחודי של אנזימים שמטרתם לנטרל את הנוגדנים המצויים על גבי האיבר. בהמשך הוזרם לתוך הריאה דם מסוג O, שמכיל נוגדנים נגד 'אנטיגן A', אולם אונת הריאה הציגה עמידות לדם שהוזרם, ללא סימני דחייה. החוקרים דיווחו על כוונתם לבצע ניסוי קליני בבני אדם בשיטה החדשה תוך שנה וחצי.
לדברי פרופ' קרמר, "אצל ילדים אנו משתילים כבר שנים איברים ללא התאמה של סוג הדם, כי אצלם הגוף נוטה להסתגל לאיבר שכזה, אולם בקרב חולים מבוגרים יש עדיין קושי. פיתוח שיטה להסרת האנטיגנים בדם האיבר המיועד להשתלה תאפשר למנוע דחייה של איברים עם סוג דם שונה מזה של החולה, ומדובר בהתקדמות שצפויה לצבור בשנים הקרובות תאוצה".
השתלות משולבות של איברים עם מח עצם
מגבלה משמעותית של מושתלי איברים קשורה בצורך בנטילה קבועה של תרופות מקבוצת האימונוסופרסנטים המשמשות למניעת דחיית השתל – תרופות שמחלישות את המערכת החיסונית וחושפות את המושתל לסיכון מוגבר לזיהומים ומחלות.
בשנים האחרונות פותחו מספר שיטות שמטרתן לנסות ולחסוך ממושתלי איברים את הצורך בתרופות כנגד דחיית השתל. השיטה שצוברת תאוצה בעולם בהקשר זה היא השתלה משולבת של איבר ומח עצם, כאשר מח העצם שמושתל מספר ימים עד שבועות לאחר התייצבות האיבר המושתל – עשוי לסייע בקליטתו המוצלחת של האיבר, ללא צורך בתרופות נוגדות דחייה.
במסגרת הטיפול, שקרוי בין השאר גם 'טיפול תאי מקל' ו'סבילות חיסונית מושרית, נאספים תאי גזע ממח העצם של התורם, עוברים עיבוד בשיטות שונות, ומוחדרים לאחר ההשתלה למושתל, באופן שהופך את המערכת החיסונית שלו למעורבת – כזו שמכילה הן תאים שלו עצמו והן של תורם האיבר. כך 'מאמנים' תאי מח העצם את המערכת החיסונית של המושתל לקבל את האיבר החדש מבלי להזדקק לטיפול ממושך בתרופות נוגדות דחייה. לדברי פרופ' קרמר, "בין תפקידיו, מח עצם לייצור של לימפוציטים – תאי הדם הלבנים במערכת החיסונית שאחראים על תגובות דחייה של איברים מושתלים. השתלת מח עצם מתורם האיברים למושתל עשויה לשפר את קליטת האיבר עד כדי האפשרות לוותר על הצורך בתרופות".
בשנים האחרונות דווח על פריצות דרך בהשתלות איברים ללא צורך בתרופות נוגדות דחייה בארה"ב, אוסטרליה ואף בישראל. עוד בינואר 2008 דיווחו חוקרים אוסטרלים בכתב העת New England Journal of Medicine על השתלה ראשונה בשיטה החדשה של כבד לילדה בת 9, השתלה שבוצעה מתורם מת בשילוב של עירוי תאי גזע שבודדו ממנת דם שנאספה מהכבד המיועד להשתלה ועברו תהליך מעבדתי – טיפול שאפשר כעבור שנה לילדה להפסיק את השימוש בתרופות נוגדות דחייה.
בארץ, במאי 2018 היו רופאים מבית החולים בילינסון הראשונים לבצע השתלה בשיטה הייחודית בישראל. המושתל היה בן 50 מאזור המרכז שסבל מאי ספיקת כליות סופנית, שאחותו תרמה לו כליה ומח עצם. לאחר מספר הצלחות כעת מפתחים בבילינסון את השיטה גם להשתלות כליה שמקורן בתורמים שמתו מוות מוחי, ובהמשך מתוכנן פיתוח השיטה גם בתרומת אונת ריאה מהמת.
"באופן תאורטי ניתן לשאוב מח עצם בהליך מקביל עם הוצאת האיברים מתורם מת, בהמשך להקפיא את מח העצם, ולאחר שהאיבר הושתל ומצב החולה התייצב – להשתיל את מח העצם, וכך להפחית ולעתים אף למנוע את הצורך להשתמש בתרופות נוגדות דחייה", מסביר פרופ' קרמר. עם זאת, יש לציין כי השיטה דורשת גם התאמה של סיווג הרקמות בין המושתל לתורם לצורך השתלת מח העצם, זאת בעוד שהשתלת איברים דורשת בעיקר התאמות לפי סוג הדם והגיל. "הטיפול החדשני עשוי לחסוך את הסיבוכים הקשים שנלווים לתרופות נוגדות דחייה, אם כי חשוב להזכיר כי גם להשתלת מח עצם עשויות להיות תופעות לוואי וסיבוכים", מדגיש פרופ' קרמר.
עוד על השתלות איברים ללא תרופות נוגדות דחייה
השתלות רחם ואיברים נוספים

(צילום: shutterstock)
לצד פיתוחים רפואיים וטכנולוגיים שמטרתם להיאבק במחסור העולמי בהשתלות כליה, כבד, לב וריאות, בשנים האחרונות מתפתח תחום ההשתלות גם להשתלות של איברים נוספים בגוף האדם.
השתלות מעיים מבוצעות בשנים האחרונות בעולם, ואף בישראל בוצעו מאז אפריל 2008 מספר מקרים בודדים של השתלות מעי. במקרה הראשון היה מדובר בנערה בת 16 שעברה השתלת אשכול איברים שכלל את המעי הדק, המעי הגס, הכבד, הקיבה והלבלב, זאת לאחר שעברה בילדותה כריתת מעי נרחבת, והייתה למעשה תלויה בהזנה תוך ורידית. בינואר 2014 דווח על השתלת המעי הראשונה בארץ לחולה מבוגר.
בשנת 1998 הושתלו לראשונה יד בצרפת ומיתרי קול בארה"ב. בשנת 2003 תועדה לראשונה השתלת לשון באוסטריה. בשנת 2005 נרשמה בצרפת פריצת דרך עם השתלת הפנים הראשונה, בשנת 2006 הושתל לראשונה פין בסין לפצוע תאונה בן 44. בשנים האחרונות דווח גם על מושתלי פין שהצליחו להביא ילדים לעולם.
מסעירה ביותר היא האפשרות שהופכת לאחרונה למציאותית לבצע השתלות רחם. השתלות אלה מאפשרות לנשים ללא רחם או ללא רחם מתפקד – להרות ולהביא ילדים לעולם, ולמרות שהחזון נשמע כחלום רחוק – הוא קרוב עתה יותר מאי פעם.
בשנת 2012 דווח בשבדיה על השתלת הרחם הראשונה בעולם מתורמת שנפטרה, ובספטמבר 2016 דווח על מושתלת הרחם הראשונה בעולם מברזיל שילדה תינוק בגיל 32. המקרה תועד בדצמבר 2019 בכתב העת Lancet. בהמשך תועדו מקרים נוספים של לידת תינוקות על ידי מושתלות רחם בארה"ב. בישראל, משנת 2016 החלו להתנסות צוותים ישראלים מהמרכז הרפואי זיו בצפת בביצוע השתלות רחם בבעלי חיים.
ביולי 2019 המליצה ועדת מומחים באיגוד הישראלי למיילדות וגינקולוגיה למשרד הבריאות לאפשר השתלות רחם גם בישראל, במסגרת מחקר שיאושר על ידי משרד הבריאות וייערך בהובלת צוות רב תחומי בראשות רופאי נשים. מאחר והטיפול עדיין מוגדר כמסוכן, כדי לצמצם את הסיכון לסיבוכים נשקלה האפשרות שהרחם יישאר בגופן של מושתלות לתקופה מוגבלת של חמש שנים בלבד. בחודשים האחרונים מבוצעים צעדים משמעותיים בחלק מבתי החולים לקידום המהלך. באחרונה הביעו גינקולוגים בכירים את התקווה כי השתלות רחם עשויות להוות פתרון לנשים עקרות, כחלופה אפשרית לטיפולי פונדקאות.
בישראל קהל היעד להשתלות רחם כולל כ-1,420 נשים שרוצות להרות ללא רחם, בין השאר על רקע 'תסמונת מאייר-רוקיטנסקי' המלווה בהפרעות בהתפתחות מערכת המין הנקבית.
פרופ' מרדכי קרמר הוא מנהל המערך למחלות ריאה והשתלות ריאה בבית החולים בילינסון מקבוצת הכללית ומנהל בקהילת מושתלים של ״כמוני״

